O Ministério da Saúde abriu, na última terça-feira (20), consulta pública para avaliar documento que define critérios para diagnóstico e tratamento da Atrofia Muscular Espinhal Tipo 1 (AME 5q). As contribuições podem ser enviadas até o dia 9 de setembro por associações de pacientes, entidades médicas ou qualquer cidadão que tenha interesse em contribuir com a elaboração do Protocolo Clínico e Diretrizes Terapêuticas da AME, que orientará profissionais de saúde, gestores do SUS e pacientes sobre o tratamento ofertado no Sistema Único de Saúde (SUS) para este tipo da doença.
Para participar e enviar contribuições, que podem ser relatos de experiências ou mesmo conteúdos científicos, acesse aqui.
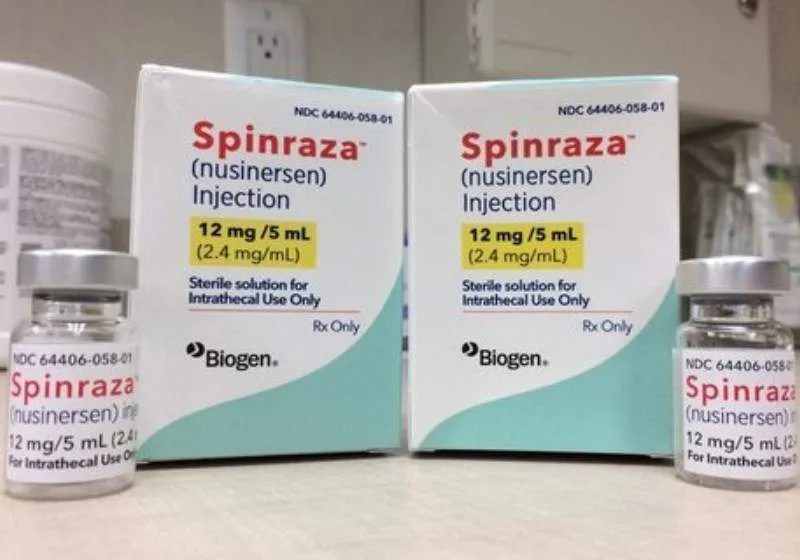
Em abril deste ano, o Ministério da Saúde anunciou a incorporação do medicamento Nusinersena (Spinraza) para o tipo 1 da AME, forma mais grave e mais prevalente da doença – praticamente seis em cada 10 pessoas diagnosticadas com AME possuem o tipo 1. Nestes casos, os inícios dos sintomas ocorrem até o sétimo mês de vida do bebê.
Para o tipo 2 (início dos sintomas entre 7 e 18 meses de vida) da doença, que corresponde a 29% dos casos, e o tipo 3 (início dos sintomas antes dos 3 anos de vida e 12 anos incompletos), que representa 13% dos casos, o Ministério da Saúde ofertará o medicamento na modalidade compartilhamento de risco. Neste formato, o governo só paga pelo medicamento se houver melhora da saúde do paciente.
Assim, ao mesmo tempo em que os pacientes fazem uso do medicamento, deverão ser acompanhados, via registro prospectivo, para medir resultados e desempenhos, como evolução da função motora e menor tempo de uso de ventilação mecânica. Atualmente, há negociações de acesso e reembolso do fármaco em 42 países, como França, Itália e Reino Unido.






